So wird Ihr Labor „lean“
Viele Labore weltweit, die klinische Durchflusszytometrie betreiben, sehen sich mit der Herausforderung konfrontiert, dass die Testzahlen steigen, während Budget und Mitarbeiterzahl unverändert bleiben. Dies führt letztlich zu einem dauerhaften Bedarf an optimierten Arbeitsabläufen und der Notwendigkeit, jegliche Verschwendungen in den Prozessen zu beseitigen.
Um Arbeitsabläufe optimieren und standardisieren zu können, müssen die gängigen Ursachen von Verschwendung in den Prozessen des Labors erkannt und eingedämmt werden, sodass mehr Zeit für andere, produktive Tätigkeiten bleibt. Viele Labore glauben, sie seien effizient, weil sie ihre Arbeitsschritte und Prozesse schon einmal auf den Prüfstand gestellt haben. Effizienz und die Beseitigung von Verschwendung erfordern allerdings eine ständige Verbesserung und sind keine einmalige Maßnahme.
Beim Übergang zu Methoden der schlanken Produktion („Lean Manufacturing“) im klinischen Labor zeigt sich, dass es sogar im effizientesten Labor immer noch Möglichkeiten gibt, weitere Verschwendung zu vermeiden und die Gesamteffizienz der bestehenden Prozesse zu verbessern.
Verfolgen Sie unseren Weg zu schlanken Workflow-Lösungen
Die 8 Verschwendungsarten
Das Konzept der 8 Verschwendungsarten stammt aus dem Toyota-Produktionssystem und wird heute auch zunehmend außerhalb der Fertigung angewendet. Das gängige Akronym für die 8 Verschwendungsarten, die durch eine schlanke Produktion beseitigt werden sollen, lautet DOWNTIME (Ausfallzeit):
- Defects (Fehler und Mängel): Aufwand, der durch Nacharbeit, Ausschuss oder falsche Informationen verursacht wird.
- Overproduction (Überproduktion): Produktion, die den Bedarf übersteigt oder erfolgt, bevor der Bedarf besteht.
- Waiting (Wartezeiten): Zeit, die mit Warten auf den nächsten Schritt in einem Prozess verschwendet wird.
- Non-utilized talent (ungenutztes Mitarbeiterpotenzial): Zu geringe Nutzung der Talente, Fähigkeiten und Kenntnisse der Mitarbeiter.
- Transportation (Transport): Unnötige Bewegung von Produkten und Materialien.
- Inventory excess (übermäßige Lagerhaltung): Verarbeitung von zu vielen Produkten und Materialien.
- Motion waste (Verschwendung durch Bewegungsabläufe): Unnötige Bewegungen der Mitarbeiter (z. B. Gehen).
- Extra processing (zusätzliche Verarbeitungsschritte): Mehr Arbeit oder höhere Qualität als vom Kunden gefordert.
Mithilfe dieser acht Punkte lassen sich Arbeitsabläufe systematisch prüfen: Ist Ihr Lagerbestand zu groß, stellen Sie fehlerhafte Produkte her oder bewegen Sie Produkte zu oft von A nach B? Dieser etablierte Ansatz lässt sich auf das klinische Labor übertragen und nutzen, um die Ineffizienzen des Routinebetriebs im klinischen Durchflusszytometrie-Labor zu untersuchen.
Fehler und Mängel
Im Routinebetrieb des klinischen Durchflusszytometrie-Labors sind viele Mängel auf menschliches Versagen zurückzuführen. Typische Fehler sind die Zugabe eines falschen Reagenzes, die inkorrekte Zubereitung eines Antikörper-Cocktails, Transkriptionsfehler oder das Vertauschen von Proben.
Überproduktion
Eine Möglichkeit, die Probenvorbereitung zu beschleunigen, ist die Zubereitung von vorgemischten Antikörper-Cocktails. Wird allerdings die Zahl der künftigen Probenanforderungen überschätzt, muss ein Teil der vorgemischten Cocktails entsorgt werden, bevor sie verwendet werden konnten.
Wartezeiten
In manchen Fällen werden Laborprozesse wegen fehlender Ressourcen ausgelagert, was mit Wartezeiten verbunden ist. Situationen, in denen es in Ihrem aktuellen Labor-Workflow wahrscheinlich besonders oft zu Wartezeiten kommt:
- Batch-Verarbeitungsengpässe
- während Zentrifugation und Inkubation
- beim Versenden von Tests in andere Labore (Durchlaufzeiten)
Ungenutztes Mitarbeiterpotenzial
Dies gilt als eine sehr spezielle Art der Verschwendung, die auf keinen Fall ignoriert werden sollte. Sie liegt vor, wenn hochqualifizierte Mitarbeiter Aufgaben ausführen, die nur eine geringe Qualifikation erfordern. Sie ist mit Opportunitätskosten verbunden, weil die Einführung neuer oder die Verbesserung bestehender Analyse-Panels unterbleibt, da die hochqualifizierten Mitarbeiter mit Pipettierung oder Bestandsverwaltung beschäftigt sind.
Transport
Transport ist nicht nur eine Prozessverschwendung, sondern auch eine Gefahr für die Umwelt. Viele Labore tun sich mit der Bestandsverwaltung schwer, weil die von ihnen bezogenen Reagenzien häufig unterschiedliche Verfallsdaten aufweisen. Außerdem ist zu berücksichtigen, dass im Rahmen einer einzelnen Reagenzbestellung mehrere temperaturgeregelte Lieferungen erforderlich sein können. Wenn eine Fremdvergabe von Tests nötig ist, ist dies wiederum mit zusätzlichen Probentransporten verbunden.
Lagerhaltung
Lieferungen von Einfarb-Reagenzien von unterschiedlichen Anbietern machen die Bestandsverwaltung mühsam und kompliziert, weil sich Qualität und Verfallsdaten unterscheiden. Dies kann dazu führen, dass Reagenzien und Antikörper-Cocktails entsorgt werden müssen, weil sie verfallen sind.
Bewegungsabläufe
Im Labor müssen die Mitarbeiter immer wieder von der Laborbank zu einem Kühlschrank oder einer Zentrifuge gehen. Wenn Sie den ganzen Tag lang Zentrifugen oder Kühlschränke öffnen und schließen, sind dies unnötige Bewegungsabläufe.
Sie wissen, dass es zu viele Pipettierschritte gibt und die Reagenzbehälter zu oft geöffnet werden müssen. Wenn Sie pipettieren, ist das ein unnötiger Bewegungsablauf. Wenn Sie transkribieren müssen, ist das ein unnötiger Bewegungsablauf. All diese Bewegungsabläufe brauchen Zeit.
Zusätzliche Verarbeitungsschritte
Zusätzliche Verarbeitungsschritte oder Testwiederholungen fallen an, wenn in irgendeiner Phase des Labor-Workflows Fehler passieren. Durch Identifizieren und Beseitigen häufiger Fehlerquellen lassen sich die Durchlaufzeit und die Effizienz verbessern.
Erfahren Sie, wie das CellMek SPS diese Verschwendungsarten beseitigt
Beurteilen der Verschwendung in Ihrem Labor Beobachten
Der Schlüssel zum Erkennen von Verschwendung ist das Beobachten, das heißt, Sie müssen den Arbeitsplatz aufsuchen und sich ansehen, wie der Arbeitsablauf dort vonstattengeht und was die Mitarbeiter tun. Allein durch Befragen von Mitarbeitern zum Arbeitsablauf oder Lesen eines Verfahrenshandbuchs lassen sich Bereiche, in denen es zu Verschwendung kommt, nicht erkennen.
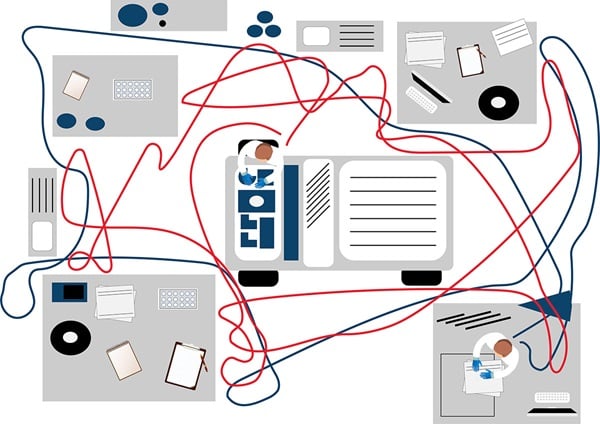
Ein beliebtes Instrument zur Darstellung von Arbeitsabläufen ist das Spaghetti-Modell oder -Diagramm. Das hier als Beispiel verwendete zeigt den Grundriss einer hypothetischen Laboreinrichtung mit zwei Mitarbeitern (Abbildung 1a). Ziel ist es, die Laufwege der Mitarbeiter zu erfassen; hierzu beobachtet jemand direkt im Labor, wohin sich die Mitarbeiter bewegen, auch wenn es sich um wiederholte Wege handelt.
Abbildung 1a. Das Spaghetti-Modell zeigt den Grundriss eines hypothetischen Labors und zwei Mitarbeiter.
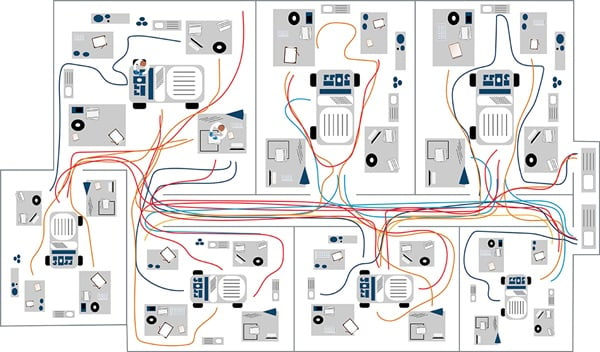
Abbildung 1b. Beispiel eines Spaghetti-Diagramms in der klinischen Durchflusszytometrie.
In diesem Beispiel eines Spaghetti-Diagramms für ein Labor steht jede Farbe für einen einzelnen Labormitarbeiter und dessen Laufwege. In dem Beispiel ist zu sehen, dass blau dargestellte Mitarbeiter die meiste Zeit in nur einem Bereich verbringen. Im Vergleich dazu ist zu erkennen, dass der Mitarbeiter mit der braunen Linie wiederholt in einen anderen Raum geht: Hier lässt sich möglicherweise Verschwendung infolge unnötiger Bewegungsabläufe verringern (Abbildung 1b). Auch der Weg einer Probe im Workflow kann mit dem Spaghetti-Model nachgezeichnet werden.
Quantifizieren
Der nächste Schritt, der genaueren Aufschluss über Ihren Workflow gibt, ist dessen Quantifizierung, indem messbare Schritte identifiziert werden:
- Wie viele Minuten dauert der Schritt?
- Wie viele Minuten warten wir?
- Wie viele Arbeitsschritte werden benötigt?
- Wie lang sind die nötigen Laufwege (gemessen in gelaufenen Schritten oder Bodenkacheln)?
- Wie viele Pipettierschritte gibt es?
- Wie hoch ist der Lagerbestand?
Dadurch wird die Ausgangssituation erfasst, sodass etwaige umgesetzte Verbesserungen des Arbeitsablaufs quantifiziert werden können.
Priorisieren
Nachdem verschwendungsbehaftete Bereiche identifiziert wurden, können sie mithilfe einer Pareto-Analyse priorisiert werden (in absteigender Reihenfolge nach Wirkung sortiert). Auf diese Weise lassen sich die Bereiche mit dem größten Verbesserungspotential identifizieren, die als Erstes angegangen werden sollten. Dieses Prinzip wird auch als 80/20-Regel bezeichnet, d. h., 80 % der Folgen gehen auf 20 % der Ursachen zurück.
Abbildung 2. Hypothetisches Beispiel eines Pareto-Diagramms für ein klinisches Durchflusszytometrie-Labor.
Der Punkt, an dem der kumulative Prozentanteil die 80 %-Marke überschreitet, gibt die Verschwendungsbereiche an, die geringe Priorität haben und zunächst nicht im Fokus stehen sollten. Auf der Grundlage des Ergebnisses sollten dann Verbesserungsmaßnahmen ergriffen und anhand des Faktors verfolgt werden, der zuvor jeweils als messbares Kriterium bestimmt wurde.
Streamlinen von Workflows in der klinische Durchflusszytometrie
Dies verdeutlichen wir nun am Beispiel eines Arbeitsablaufs in einem klinischen Durchflusszytometrie-Labor, der auf das Spaghetti-Diagramm aus Abbildung 1a aufbaut.
Für die Entwicklung eines Tests kauft das Labor mehrere separate Einfarb-Reagenzien ein und kombiniert sie zu einem Test, der die gewünschten Ergebnisse liefert.
Üblicherweise umfasst dieser Test-Workflow die folgenden Schritte:
1. Bestandsprüfung
Der Bestand an Einfarb-Antikörpern wird geprüft und es werden diejenigen entsorgt, deren Verfallsdatum abgelaufen ist. Antikörper sind nur für eine begrenzte Zeit stabil, und das Haltbarkeitsdatum jedes Antikörpers muss dokumentiert werden. Wenn Reagenzien entsorgt werden müssen, weil ihr Verfallsdatum abgelaufen ist, müssen Einfarb-Antikörper nachbestellt werden, und das Labor muss auf die Lieferung warten. Nach der Lieferung müssen die Antikörper und ihr Lagerort, Verfallsdatum, Anbruchdatum usw. dokumentiert werden.
Abbildung 3. Workflow für die Bestandsprüfung.
2. Panel-Erstellung
Wenn die Testdurchführung ansteht, wählen Labormitarbeiter die benötigten Einfarb-Antikörper aus, bringen sie aus dem Kühlschrank zur Laborbank und öffnen alle Verschlüsse. Anschließend werden die Einfarb-Reagenzien in vielen Laboren noch von Hand pipettiert.
In diesem Workflow wird angenommen, dass ein Panel mit 10 Farbstoffen erstellt wird (d. h. 10 Antikörper pro Röhrchen, denn es handelt sich um 10-Farb-Durchflusszytometrie). Zur Erstellung des Panels werden beispielsweise vier Röhrchen benötigt (die tatsächliche Gesamtzahl hängt vom jeweiligen Panel ab). Der Prozess beinhaltet viele Ursachen von Verschwendung, zur Verdeutlichung beschränken wir uns hier jedoch auf die Verschwendung im Zusammenhang mit dem letzten Schritt, der Pipettierung der Einfarb-Antikörper, weil es sich hierbei um einen zeitaufwändigen, manuellen und fehleranfälligen Arbeitsschritt handelt.
Pipettieren ist, wenn es manuell erfolgt, ein repetitiver Bewegungsablauf, denn die Labormitarbeiter müssen jeden Antikörper einzeln pipettieren, in insgesamt 40 Pipettierschritten. Dazu kommt noch das Öffnen und Verschließen der Flaschen.
Abbildung 4. Workflow für die Bestandsprüfung und die Erstellung eines 10-Farb-Panels
3. Beispiele für Verbesserungsmaßnahmen
Anstatt dass Labormitarbeiter alle Reagenzien einzeln für jede einzelne Probe pipettieren, wäre es eine denkbare Verbesserungsmaßnahme, Cocktails aus Einfarb-Antikörpern zuzubereiten (Abbildung 5). In diesem Beispiel werden vier verschiedene Antikörper-Cocktails für fünf Patientenproben zubereitet. Dies entspricht einem Cocktail je vier Röhrchen und reduziert die Zahl der Pipettierschritte von 200 (40 Antikörper mal 5 Proben) auf 60 (4 Cocktails mit je 10 Antikörpern plus Pipettieren der Cocktails für 5 Proben) – eine deutliche Verbesserung, die mit weniger Fehlerquellen und weniger repetitiven Bewegungen verbunden ist.
Allerdings fällt durch die Einführung dieses Schritts in den Workflow zusätzliche Arbeit für die Herstellung der Mehrfarb-Cocktails aus Einfarb-Antikörpern unter Verwendung von Flüssigreagenzien an. Hierbei ist eine zusätzliche Qualitätskontrolle (QK) erforderlich und je nach Auftragsaufkommen könnte es passieren, dass Cocktails ablaufen und entsorgt werden müssen.
Außerdem löst die Herstellung von Mehrfarb-Cocktails aus Einfarb-Antikörpern nicht die Probleme in der ersten Phase des Workflows. Der Arbeitsablauf beim Eingang der Einfarb-Antikörper ist aufwändig und wurde noch nicht verbessert. Ein alternativer Ansatz wäre die Verringerung der Röhrchenzahl, von drei auf vier. Dies könnte durch die Umstellung von einem 10-Farb- auf ein 13-Farb-Durchflusszytometer oder durch Marker-Stacking im Panel erreicht werden.
Abbildung 5. Workflow für die Bestandsprüfung und Zubereitung von Mehrfarb-Cocktails zur Erstellung eines 10-Farb-Panels
Alternative Möglichkeiten, um Verschwendung zu reduzieren, sind beispielsweise der Verzicht auf Einfarb-Reagenzien oder die Installation eines automatisierten Probenvorbereitungssystems, um die Testkapazität des Labors auszubauen. Dies trifft insbesondere für Labore zu, deren Schwerpunkt auf komplexen laborentwickelten Tests mit unterschiedlichen Workflows liegt. Welche Vorgehensweise am besten zu seinen Erfordernissen passt, muss jedes Labor aber letztlich selbst für sich entscheiden.
Zusammenfassung
Effiziente Arbeitsabläufe sind im Zytometrie-Routinelabor äußerst wichtig, und es können mehrere Maßnahmen ergriffen werden, um sie zu optimieren.
- Wählen Sie leicht erreichbare Ziele im Bereich der Labortests und gestalten Sie die Prozesse so um, dass manuelle Aktionen und Transkriptionsschritte möglichst entfallen. Beide gehen immer mit arbeitsintensiven Prozessen einher und stellen erhebliche Fehlerquellen dar.
- Prüfen Sie, wo sich durch eine Vereinfachung der Bestandsverwaltung und eine Verringerung der Batch-Verarbeitung Zeit einsparen lässt.
- Maximieren Sie Ihre Multiparameterkapazität, sodass Sie weniger Röhrchen bearbeiten müssen und somit auch weniger Arbeitskraft benötigen.
- Der Einsatz von weniger Röhrchen führt zu einer geringeren Antikörper-Redundanz und einem geringeren Reagenzverbrauch.
- Nutzen Sie das Konzept des Marker-Stackings, um noch mehr Marker in einem Röhrchen zu bündeln, und maximieren Sie auf diese Weise die Multiparameterkapazität.